Introducción.
La criptococosis es una micosis sistémica aguda, subaguda o crónica, inicialmente pulmonar causada principalmente por Cryptococcus neoformans (vars. neoformans y grubii) y Cryptococcus gattii. La forma pulmonar es generalmente transitoria, leve y no reconocida. Las lesiones cutáneas, óseas o viscerales pueden presentarse durante la diseminación de la enfermedad, pero la inclusión del sistema nervioso central con meningitis subaguda o crónica es la forma más familiar de la micosis. Aunque el hongo tiene una amplia distribución mundial y se encuentra de manera abundante en la naturaleza, solamente causa enfermedad grave en personas con resistencia inmunológica muy baja. En la actualidad, la incidencia de la criptococosis es paralela a la presentada por el SIDA.
Taxonomía.
Reino: Fungi
Phylum: Basidiomycota
Orden: Tremellales
Familia: Tremellaceae
Género: Cryptococcus
Especies: neoformans var. grubii, neoformans var. neoformans, gattii, albidus, laurentii
Y aproximadamente, otras 35 especies más que continuamente se están reclasificando. Se han registrado casos raros provocados por Cryptococcus albidus, C. laurentii y C. uniguttulatus; formalmente se reconoce a C. neoformans y C. gattii, como los agentes etiológicos de la criptococosis en mamíferos.
Ecología.
Se ha postulado que C. neoformans/C. gatttii pueden ser hongos levaduriformes endo o epífitos, que desarrollan una asociación biotrófica específica con plantas hospederas. La dispersión de las basidiosporas ocurre con la floración de dichas plantas; las basidiosporas aéreas están presentes en el ambiente por períodos de tiempo cortos y son propágulos infecciosos para el humano y otros animales. Después de su diseminación, las basidiosporas pueden sintetizar material polisacárido y convertirse en levaduras capsuladas. Los mamíferos y aves que tienen alguna asociación con la planta hospedera pueden pasar los criptococos a través de su intestino y eliminar levaduras capsuladas en heces fecales. Los criptococos en el suelo o en detritos vegetales son eliminados del ambiente por acción de la intemperie, especialmente los rayos solares y microorganismos como bacterias y amibas, pero los criptococos acumulados en cobertizos pueden permanecer viables durante varios años, permitiendo que estos hábitats actúen como fuentes importantes para la dispersión de levaduras desecadas, también infecciosas. C. neoformans var. grubii y var.neoformans se han aislado a partir de varias fuentes naturales (vegetales, frutas, jugos de frutas, madera, productos lácteos y suelo), pero es notoria su asociación con deshechos aviarios (pericos, loros, canarios) y especialmente con excrementos de palomas. Por otro lado, los aislamientos ambientales de C. gattii (serotipos B y C), han establecido que esta especie tiene una asociación ecológica estrecha con especies de árboles de eucalipto en Australia como Eucalyptus camaldulensis, E. tereticornis, E. rudis y E. gomphocephala, así como Terminalia catappa en Colombia y Moquilea tomentosa en Brasil.
Epidemiología.
En cuanto a frecuencia, la criptococosis se consideraba esporádica, pero el número de casos aumentó exponencialmente con la aparición del SIDA. Aunque puede presentarse en pacientes aparentemente inmunocompetentes, la afección está íntimamente ligada a personas con deficiencias en el sistema inmunitario.
Se ha apreciado una estrecha relación entre C. neoformans en pacientes con SIDA y C. gattii en pacientes inmunocompetentes.
La criptococosis tiene una distribución geográfica amplia. Los casos causados por C. neoformans var. grubii predominan en lugares de clima templado, principalmente en EUA (excluyendo sur de California y Hawai) y Japón y C. neoformans var. neoformans(serotipo D) en Europa. Por otra parte, los casos provocados por C. gattii provienen principalmente de África, Latinoamérica, Sur de EUA (California), Australia y Canadá.
• Incidencia diferencial. No hay diferencias marcadas relacionadas a la edad, raza u ocupación en la frecuencia de la criptococosis. La micosis es más frecuente en hombres que en mujeres (3:1).
• Vía de infección. Es aérea, las partículas infecciosas penetran al hospedero a través de la inhalación. Excepcionalmente, se presentan casos cutáneos primarios, ocasionados por la entrada del agente mediante una solución de continuidad.
Morfología.
—Estado anamorfo o mitospórico. La reproducción asexual representa el estado anamórfico, el cual está caracterizado por la producción de células levaduriformes gemantes (propágulos asexuales), que típicamente desarrollan una gran cápsula compuesta por polisacáridos. El arreglo de los componentes capsulares determina alguno de los cuatro serotipos de la levadura: A, B, C ó D. Las levaduras son redondas (4-6 µm de diámetro) o en ocasiones ovaladas y excepcionalmente formadoras de seudomicelio. Tanto las levaduras madre, como los blastoconidios se caracterizan por la presencia de cápsula.
—Estado Teleomorfo. El estado sexual del hongo está caracterizado por la producción de basidiosporas (propágulos sexuales). Filobasidiella neoformans es el teleomorfo de C. neoformans y F. bacillispora, lo es de C. gattii. El género Filobasidiella es un basidiomiceto, con dos tipos sexuales: «a» y «alfa» caracterizados por tener el micelio hialino, consistente en hifas dicarióticas y un basidio alargado, portando basidiosporas sésiles y en cadena (gemación basípeta).
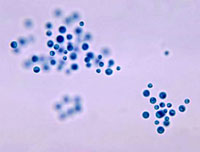
Cryptococcus neoformans. Levaduras encapsuladas. Imaagen: CDC/ Leanor Haley
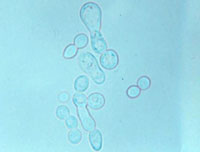
Cryptococcus albidus. Imagen: L. R. Castañón, Facultad de Medicina, UNAM
Factores de virulencia.
Las características más estudiadas sobre C. neoformans son la presencia de la cápsula polisacárida y la producción de melanina. El polisacárido capsular puede: Inhibir la producción de ciertas linfocinas provocando respuestas tanto celular como humoral muy débiles, enlazar e inmovilizar parcialmente a los anticuerpos dirigidos contra la pared celular y la cápsula del hongo y además, enmascarar a los anticuerpos.
La presencia de la melanina funciona como un escudo que protege al hongo contra: anticuerpos del hospedero, agentes oxidantes y la anfotericina B. Otros parámetros que pudiesen estar relacionados con la patogenicidad de este hongo son:el tipo sexual, la biosíntesis de adenina, producción de manitol y ureasas y presencia de miristoil-transferasas.
Fisiopatogenia.
Al entrar por las vías respiratorias altas, el hongo coloniza el árbol bronquial, y la evidencia sugiere que la criptococosis inicia como una enfermedad pulmonar con diseminación a la piel, huesos, vísceras abdominales y particularmente hacia el sistema nervioso central.
Generalmente, las lesiones pulmonares sanan espontáneamente y son asintomáticas. La criptococosis pulmonar benigna, probablemente representa una ligera o mínima exposición y se llega a identificar por el hallazgo accidental en autopsia de un granuloma subpleural encapsulado.
Las lesiones activas son granulomatosas o mixomatosas y pueden estar caracterizadas por masas de células de C. neoformansque debido a su crecimiento y cápsula producen desplazamiento mecánico de tejidos del hospedero. Si las lesiones de este tipo penetran la pared de un bronquio, se descarga un gran número de células fúngicas en el esputo. Las lesiones pulmonares de criptococosis no calcifican y es probable que la mayoría de ellas sanen sin formar “criptococomas” y sin dejar evidencia.
En la autopsia, las lesiones pulmonares primarias se observan como nódulos de 1 – 7 cm de diámetro, localizados cerca de la superficie pleural, del hilio o en el centro del lóbulo. En pulmones con infección criptococal progresiva, las lesiones se aprecian como granulomas miliares, pequeños abscesos, o lesiones mucoides grandes y sólidas ás lóbulos.
Posteriormente, el hongo se disemina por el torrente sanguíneo, vía de infección habitual al sistema nervioso central y de otros órganos.
En el sistema nervioso central, los datos clínicos están asociados con el desarrollo de lesiones granulomatosas en las meninges. En la necropsia, la reacción meníngea se hace notoria en la base del cerebro y la parte dorsal del cerebelo, con membranas espesas y opacas. En el espacio subaracnoideo se presenta, de forma característica, un exudado mucoide adherente semejante a pequeñas «burbujas de jabón». Quitando la membrana, en la superficie de la corteza pueden observarse múltiples y finos hoyuelos. Se aprecian focos quísticos con masas de levaduras, predominantemente localizados en la materia gris, los cuales pueden estar en comunicación con la superficie pero también pueden presentarse en la materia gris.
El mismo patrón de lesiones granulomatosas, visto en pulmones y sistema nervioso central se da en los tejidos de cualquier órgano afectado.
La apariencia mucoide causada por criptococos es consecuencia de las numerosas células de C. neoformans presentes y la reacción celular tenue. Cuando C. neoformans/C. gattii provocan una reacción celular marcada, las lesiones no pueden ser distinguidas histopatológicamente de otras enfermedades granulomatosas.
Debido a la encapsulación del hongo, la reacción de defensa del hospedero es relativamente tardía. Dependiendo del grado de desarrollo capsular, las reacciones celulares (granulomas y ocasionalmente necrosis) generalmente aparecen en infecciones avanzadas.
Formas clínicas.
Pese a la ocurrencia ubicua de Cryptococcus neoformans, no es frecuente que se desarrolle una enfermedad clínicamente importante en el hombre. Las manifestaciones más severas de la micosis y su frecuencia están asociadas a una seria deficiencia inmunitaria local o sistémica del paciente. Por consiguiente, la criptococosis es más frecuente en personas con enfermedades como SIDA, Hodgkin, leucemia, linfosarcoma, diabetes mellitus y en pacientes con terapias prolongadas con esteroides.
• Criptococosis pulmonar. Generalmente, las lesiones pulmonares se encapsulan y sanan. La criptococosis pulmonar crónica ha sido reportada ocasionalmente. Las manifestaciones clínicas no son específicas; los principales signos y síntomas son: tos y escaso esputo mucoide con o sin hemoptisis, febrícula, malestar general y pérdida de peso. Un estado inmunológico deficiente puede determinar el que las levaduras se diseminen “silenciosamente” a través del torrente sanguíneo a otros órganos, principalmente hacia sistema nervioso central.
• Criptococosis del sistema nervioso central (SNC). Las manifestaciones corresponden a una meningitis (el cuadro más frecuente en inmunodeprimidos), meningoencefalitis o lesiones focales con cefalea intermitente. Aunque el resultado usualmente es insidioso y el curso crónico, el paciente puede desarrollar súbitamente vértigo, cefalea frontal severa, temporal o postorbital y vómito. El curso agudo y severo puede indicar la presencia de lesiones cerebrales de rápida diseminación. Los datos clínicos corresponden a los de una lesión intracraneal extensa o meningitis cerebroespinal con fiebre elevada, rigidez de nuca (moderada). Los signos y síntomas solo son aparentes en un 30% de los sujetos. El paciente puede estar irritable o apático, incoherente o comatoso. Los reflejos de rótula y talón pueden estar disminuídos pero algunos pacientes muestran hiperreflexia. Se puede presentar papiledema importante que requiere de frecuentes drenajes espinales para prevenir un daño óptico irreversible. Signos como ambliopía, diplopía, estrabismo, nistagmus, fotofobia, neurorretinitis, hemorragia retinal y atrofia del nervio óptico pueden mostrarse. La duración de la criptococosis del SNC varía de pocos meses a 15 – 20 años, aunque el curso usual es rápido y marcado por una deterioración progresiva. En la mayoría de los casos crónicos, hay períodos de remisión y eventualmente se presenta la recurrencia a la enfermedad progresiva.
Las lesiones focales por Cryptococcus se manifiestan hasta en1/5 parte de los pacientes con SIDA. Dan lugar a datos de una masa ocupativa, tales como fiebre, dolor de cabeza, convulsiones, hemiparesia y estado mental alterado.
• Criptococosis cutánea. Cursa generalmente de forma simultánea con una infección sistémica y precedida por una infección respiratoria, pero existen casos que han sido diagnosticados sin una lesión pulmonar preexistente. Las lesiones cutáneas consisten en infiltraciones dérmicas que crecen lentamente con contornos a menudo fijos, ocasionalmente fluctuantes, semejantes al eritema nodoso. Los nódulos cutáneos ulcerativos de color rojo-azulado que aparecen posteriormente pueden presentar configuraciones muy variadas y tener aspecto acneiforme, como pápulas y pústulas o abscesos subcutáneos con superficies irregulares y granulomatosas con ulceración, presentando a menudo infiltración e induración. Las úlceras pueden ser solitarias o múltiples, en ocasiones con apariencia de carcinoma o goma.
Las lesiones en las mucosas no están consideradas como sitios primarios de inoculación, a menos que exista linfoadenopatía regional, pero es factible la diseminación hematógena o extensión de una lesión cutánea. Las lesiones mucosas oronasales son nodulares, granulomatosas o úlceras superficiales.
• Criptococosis ósea. Las lesiones ocurren en alrededor del 10% de los casos reportados. Se diseminan lentamente sin proliferación periosteal, pero frecuentemente hay osteolisis con diseminación a piel por extensión o seguida de una exploración quirúrgica, con multiplicación del hongo que contribuye a la secreción de pus.
• Criptococosis visceral. Cualquier órgano o tejido del cuerpo es susceptible de invasión. Las Lesiones granulomatosas son habitualmente sintomáticas, con parecido histológico a cáncer maligno. Las lesiones del ojo incluyen papiledema, uveitis, retinitis y queratitis. La endocarditis es una manifestación rara.
Estudios de gabinete.
— Radiología torácica. Aunque las características radiológicas de la criptococosis pulmonar son variadas, la mayoría de los autores sugieren básicamente tres tipos de patrones: masas, consolidación de espacios aéreos y opacidades bilaterales y múltiples. Las masas pulmonares pueden presentarse como nódulos múltiples, pero lo habitual son nódulos solitarios típicamente localizados en la periferia del pulmón, de tamaño variable (de milímetros a varios centímetros de diámetro). De forma muy esporádica se presenta cavitación dentro de las consolidaciones. Se asocia con linfoadenopatía, que puede ser masiva. El derrame pleural no es una manifestación común. El patrón de pequeños nódulos bilaterales y múltiples u opacidades reticulonodulares difusas se asocia con la diseminación de tipo sistémico y son más frecuentes en individuos inmunocomprometidos, en los cuales se aprecian cavitaciones, adenopatías y derrame pleural.
— Neuroradiología. La mayoría de los pacientes con criptococosis en SNC no presentan habitualmente anormalidades en la tomografía computada (TC); sin embargo, algunas de las imágenes observadas en TC, resonancia magnética (normal y con pulsos T2), han mostrado: hidrocefalia, aumento meníngeo extenso, obliteración del cuarto ventrículo, granuloma intraventricular, edema rodeando a la fisura de Silvio, aumento del lóbulo frontal y occipital, cuerpo calloso, cerebelo y plexo coroide. Las imágenes muestran múltiples lesiones nodulares hipodensas y/o pequeñas calcificaciones dispersas. Con menor frecuencia se observan alteraciones en los ganglios basales, tálamo y médula espinal.
— Radiología músculo-esquelética. Las lesiones son de tipo osteolítico con márgenes discretos con poca o ninguna reacción periosteal. La periosteitis es limitada.
— Radiología abdominal. Las imágenes, compatibles con una hepatitis son variables, corroboran la hepatomegalia y presentan ecogenicidad hepática disminuída. La sonografía y TC ayudan en la identificación de masas en lesiones biliares.
El urograma, puede revelar lesiones en próstata.
Diagnóstico de laboratorio.
El líquido cefalorraquídeo es el espécimen en donde con mayor frecuencia se hace el diagnóstico de criptococosis; sin embargo otros productos como esputo, pus, orina, material fecal y muestras de tejido también pueden ser analizados.
— Examen directo en fresco con tinta china o nigrosina. El tamaño de C. neoformans/C. gattii (4 – 20 µm de diámetro) permite una fácil observación con tinción negativa, y ayuda a diferenciar al hongo de los linfocitos con los cuales algunas veces es confundido. Este estudio en fresco solo requiere agregar tinta china al producto patológico, lo que revela una clara aureola, imagen debida a la cápsula, en torno a las células de Cryptococcus. Muy ocasionalmente pueden observarse seudomicelios. Ante un examen directo negativo, es de gran utilidad centrifugar el líquido cefalorraquídeo o la orina, a 3000 rpm/10 min, reservando el sedimento para su examen al microscopio y cultivo. El esputo y el pus, pueden mezclarse con una solución al 10% de hidróxido de sodio antes del examen. En un espécimen apropiadamente preparado, las células del pus y desechos celulares digeridos delinean la cápsula, la cual es resistente al hidróxido. En un fragmento de tejido macerado, sin digestión preliminar, la cápsula es prominente.
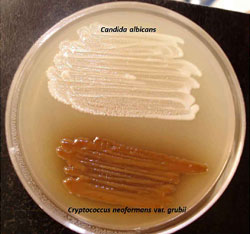
— Cultivo. Cryptococcus neoformans/C. gattii son fáciles de cultivar en los medios convencionales (Sabouraud dextrosa, malta dextrosa, papa dextrosa), adicionados con cloranfenicol y sin cicloheximida. Los cultivos se mantienen a 30ºC y a 37ºC, al menos durante una semana. El cultivo levaduriforme es inicialmente blanco, pero posteriormente se torna beige y marrón-amarillo. Si las levaduras poseen grandes cápsulas, esto se verá reflejado en la presentación de una morfología colonial de aspecto brillante, mucoide y escurrente; por el contrario, si el material capsular es escaso, la morfología macroscópica se traducirá en colonias secas y opacas. El medio de Níger (Staib agar), es aconsejable como primocultivo, sobre todo en los casos del aislamiento del hongo a partir de especímenes muy contaminados, como esputo o materia fecal. En este medio, las colonias de C. neoformans crecen de color marrón obscuro, distinguibles de otras levaduras como Candida spp, Trichosporon spp o Rhodotorula spp.
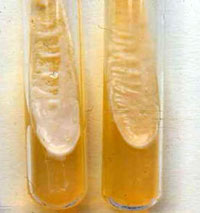
Cryptococcus neoformans. Cultivo agar dextrosa Sabouraud. Imagen: L. R. Castañón, UNAM
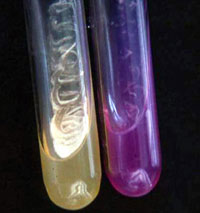
Cryptococcus neoformans. Derecha: Ureasa +. Imagen: E. Sánchez Paredes, UNAM
Bioquímica. C. neoformans/C. gattii, comparten con el resto de los miembros del género, las siguientes características: son levaduras ureasa positivos, no reductores de nitratos a nitritos, no fermentadores de azúcares, pero son las únicas especies que crecen bien a 37ºC y manifiestan la presencia de laccasas (productoras de melanina) cuando crecen sobre sustratos que contienen compuestos polifenólicos como el agar Níger o el agar-DOPA. C. neoformans se diferencia con facilidad de C. gattii pues en agar CGB es sensible a la L-canavanina y no utiliza la glicina como única fuente de carbono y nitrógeno, asimila la D-prolina y sus ureasas son resistentes a la acción del EDTA; C. gattii presenta las propiedades inversas.
Crecimiento en agar Níger a 25°C. Se observa producción de pigmento melánico que da un color marrón obscuro a las colonias de C. gattii y C. neoformans. Imagen: E. Bazán-Mora, UNAM.
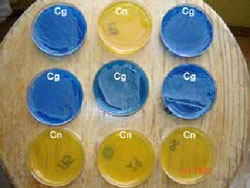
Crecimiento en agar CGB (canavanina-glicina-azul de bromotimol), útil para diferenciar a los agentes etiológicos de la criptococosis: C. neoformans (Cn) y C. gattii (Cg). Imagen: LR Castañón-Olivares, UNAM.
Serología. Las pruebas tradicionales, tales como la identificación de anticuerpos fluorescentes, hemaglutinantes y fijadores del complemento, han sido poco satisfactorias debido a que la producción de anticuerpos es muy débil; en cambio, el polisacárido capsular es demostrable en los productos patológicos (especialmente en líquido cefalorraquídeo, suero y orina) durante fases activas de la micosis. Por lo anterior, la prueba de aglutinación con látex sensibilizado con anticuerpos anti-Cryptococcus, es la prueba diagnóstica de elección, debido a su alta sensibilidad y especificidad para reconocer al antígeno polisacárido. La prueba de aglutinación con látex también se correlaciona con los ascensos y descensos de los títulos de anticuerpos durante el curso de la enfermedad y la respuesta al tratamiento.
La prueba de aglutinación con látex es útil para efectuar el diagnóstico, e identifica a los diferentes serotipos (A, B, C y D) que conforman al complejo C. neoformans/C.gattii.
Pruebas de identificación.
En el año 2007 fue formado el Grupo de Trabajo Genotyping of Cryptococcus neoformans and C. gattii, bajo el cobijo de la International Society of Human and Animal Mycology. El grupo seleccionó la Tipificación por Secuencias Multi-locus (MLST por sus siglas en inglés), por su poder discriminatorio y reproducibilidad, para genotipificar mundialmente cualquier aislado de C. neoformans/C. gattii. El consenso del esquema MLST es usar siete loci genéticamente diferentes que incluyen los genes estructurales de cápsula, laccasas, superóxido dismutasas y pirofosforilasas: CAP59, GPD1, LAC1, PLB1, SOD1, URA5 y la región IGS1. La información acerca del tipo de alelos y secuencias está accesible en: http://www.mlst.net/.
Histopatología.
En general, la criptococosis está caracterizada por la falta de reacción histológica. Las lesiones por criptococos pueden presentar un cuadro de granuloma histiocítico puro. Grandes histiocitos mono o multinucleados se apoyan en un delicado estroma. Varios campos microscópicos pueden observarse con solo este tipo de célula inflamatoria, aunque ocasionalmente se aprecian algunos linfocitos. En secciones teñidas con hematoxilina-eosina, las células fúngicas aparecen de color azul pálido, frecuentemente de pared delgada, cuerpos ovales o esféricos sin estructuras internas visibles o mal definidas. El tamaño de las células varía. El diámetro de la mayoría de ellas, sin incluir la cápsula, oscila entre 4 – 10 µm. En lesiones activas, células gemantes son encontradas sin dificultad. En lesiones viejas o aquellas con importante reacción celular y pocas células fúngicas, la gemación es difícil de demostrar. Cuando la gemación es extremadamente activa pueden presentarse seudohifas.
La criptococosis está caracterizada por la falta de reacción histológica; el hongo se multiplica en abundancia en histiocitos. La necrosis no es característica pero se ha reportado en nódulos pulmonares fibrocaseosos y de manera ocasional en las glándulas adrenales, probablemente como resultado de una proliferación semejante a un tumor. La identificación de C. neoformans/C. gattii en la característica lesión mixomatosa, puede ser satisfactoria con la tinción de hematoxilina-eosina, en donde las células fúngicas aparecen de color azul pálido, frecuentemente de pared delgada, cuerpos ovales o esféricos sin estructuras internas visibles o mal definidas. Pero la morfología se estudia más adecuadamente con tinciones fúngicas específicas: los preparados histológicos del material de biopsia se tiñen con PAS, con la cual las células fúngicas adquieren aspecto rojo; con la técnica de Grocott-Gomori las células de Cryptococcus se observan negras y para identificar cápsula, se recomienda la técnica de mucicarmín de Mayer.
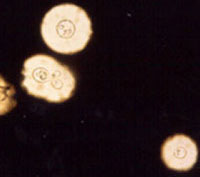
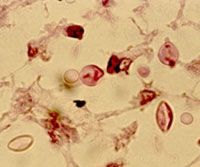
Examen directo con tinta china. Se aprecian la cápsula y gemación de las levaduras. Imágenes: Dr. Luis Javier Méndez Tovar, C.M.N. Siglo XXI.