La familia Enterobacteriaceae está formada por más de 20 géneros bacterianos, aproximadamente 120 especies y miles de serotipos (combinación del antígeno somático y el flagelar). Las bacterias de esta familia, son anaerobias facultativas. La mayor parte son de vida libre, algunas son comensales de animales vertebrados e invertebrados. Sin embargo, también pueden ser patógenos causantes de enfermedad.
Escherichia coli es la especie bacteriana más común de la microbiota intestinal; se presenta como un comensal del intestino humano pocas horas después del nacimiento. Es raro encontrar cepas comensales asociadas a enfermedad. Empero, existen varios patotipos de E. coli implicados en un amplio espectro de enfermedades agrupados en tres síndromes clínicos. (Iguchi et al., 2009).
Escherichia coli y otras bacterias son necesarias para el funcionamiento correcto del proceso digestivo, además de ser responsables de producir vitaminas B y K. El tamaño promedio de los bacilos es de 0.5 µ de ancho por 3 µ de largo, cuando se utiliza la tinción de Gram se tiñen de rojo (gramnegativas). Algunas especies son móviles (por flagelos perítricos), no esporuladas, fermenta la glucosa y la lactosa son catalasa positivos, oxidasa negativos y reduce nitratos a nitritos. El género Escherichia incluye siete especies (E. adecarboxylata, E. alberti, E. blattae, E. fergusonii, E. hermannii, E. vulneris y E. coli).
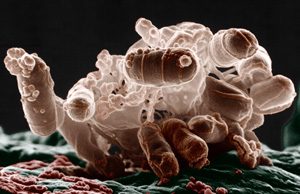
Escherichia coli. Micrografía de barrido. Racimo de bacterias. Foto: Eric Erbe; coloración: Christopher Pooley. USDA, ARS, IS Photo Unit.
Estudios epidemiológicos moleculares han clasificado a las diferentes cepas de E. coli en filogrupos: A, B1, B2, D y E.
Los patotipos involucrados en infecciones extraintestinales se han denominado ExPEC3.
Algunos patotipos causantes de enfermedad también se encuentran asociados a infecciones en diversos animales y utilizan factores de virulencia presentes en las cepas humanas y otros factores.
Estructura antigénica de Escherichia coli.
En 1944, Kauffman propuso un esquema para la clasificación de E. coli utilizando sueros de conejos inmunizados con las variedades de los antígenos O (somático), H (flagelar) y K (capsular).
El antígeno O es un polisacárido termoestable, que forma parte del lipopolisacárido (LPS) presente en la membrana externa de la bacteria. El antígeno K corresponde al polisacárido capsular que envuelve a la bacteria. Actualmente se conocen un total de 185 antígenos somáticos, 56 flagelares y 60 capsulares. La combinación específica de los antígenos O y H define el serotipo de una bacteria, en tanto que la identificación del antígeno somático hace referencia al serogrupo de la cepa de E. coli.
Escherichia coli y la enfermedad diarreica.
La diarrea aguda es una enfermedad intestinal generalmente infecciosa y autolimitada, se caracteriza por presentar evacuaciones líquidas o de consistencia disminuida, en número mayor a tres en 24 horas y con evolución menor de dos semanas. Diarrea persistente se define como el paso de evacuaciones semilíquidas por más de dos semanas, en tanto que la diarrea crónica se establece a las cuatro semanas.
La enfermedad diarreica grave (EDA), es uno de los problemas de salud pública de mayor importancia en el mundo. De acuerdo con estudios efectuados por la Organización Mundial de la Salud (OMS) y el fondo de las naciones unidas para la infancia (UNICEF), las EDA son un problema de salud de la población infantil, principalmente en los países en desarrollo donde se producen anualmente entre 5 a 6 millones de muertes, constituyendo la segunda causa global de mortalidad infantil.
La diarrea afecta a todos los grupos de edad. El periodo pediatrico de mayor vulnerabilidad incluye a los menores de 5 años (SSA), quienes se deshidratan con mayor rapidez.
En México, el Instituto Nacional de Salud Pública estima que se recetan antibióticos a 70% de los pacientes con infecciones respiratorias y diarreicas agudas, lo que se justifica solamente en un 15% de los casos. Steffen, director de la campaña del Día Mundial de la Salud Digestiva, señaló que el 20% de las muertes infantiles se debe a diarrea y sólo el 39% de los niños con diarrea recibe el tratamiento recomendado.
E. coli es responsable de aproximadamente 630 millones de casos de diarrea en el mundo y entre 5 a 6 millones de muertes al año, afectando principalmente a la población infantil de países en desarrollo. Además se ha reportado su participación en cerca del 50% de las UTI intrahospitalarias y en el 90% de las infecciones de este tipo en pacientes ambulatorios.
Síndromes clínicos.
Las cepas de Escherichia coli causantes de diarrea se han agrupado en seis tipos patógenos, cada uno definido por sus propiedades de virulencia: E. coli enteropatógena (EPEC), enterotoxigénica (ETEC), enterohemorrágica (EHEC), enteroinvasiva (EIEC), con adherencia difusa (DAEC) y enteroagregativa (EAEC). Cada uno de los grupos patógenos de E. coli presenta características distintivas relacionadas con su epidemiología, patogénesis, manifestaciones clínicas y tratamiento.
Síndromes clínicos |
Escherichia coli patógenas |
Enteritis/ enfermedad diarreica |
E. coli enteropatogénica – EPEC |
E. coli enterohemorrágica – EHEC |
|
E. coli enterotoxigénica, ETEC |
|
E. coli enteroagregativa – EAEC |
|
E. coli enteroinvasiva – EIEC |
|
E. coli adherente difusa – DAEC2 |
|
Infecciones del tracto urinario |
E. coli uropatogénica – UPEC |
Sepsis/meningitis |
MNEC |
— Escherichia coli enteropatógena (EPEC).
Se considera una de las principales etiologías de diarrea infantil en países en desarrollo.
Cravioto reportó en 1977 que las cepas de E. coli del grupo EPEC presentaban la capacidad de adherirse a células HEp-2 (línea celular de carcinoma faríngeo humana) formando microcolonias (Figura 1). Este patrón fue denominado posteriormente como adherencia localizada por Scaletsky.
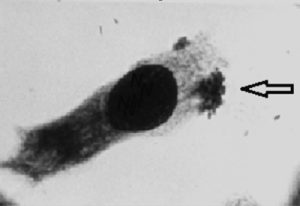
Figura 1. Adherencia localizada (AL) en células HEp-2 de una cepa EPEC a 3 h. de incubación. Flecha = microcolonia bacteriana (AL). Imagen: José Molina, Facultad de Medicina, UNAM.
Una vez formadas las microcolonias comienza una segunda fase de adherencia, con la destrucción de las microvellosidades intestinales, proceso al que se ha denominado como esfacelamiento. La falta de microvellosidades permite a las bacterias adherirse en forma íntima a receptores de la membrana presentes en la célula epitelial.
Factores de virulencia.
Entre los factores de virulencia que portan cepas EPEC se encuentra la adherencia a células intestinales in vivo y a células cultivadas (in vitro); dicha adherencia está codificada en un plásmido de 60 mDa, llamado factor adherente EPEC (EAF).
También cuenta con genes cromosomales nombrados eae A y B que operan en combinación con los genes plasmídicos y dan lugar a una proteína de 94 kDa (intimina) asociada a la producción de la lesión de adherencia íntima y esfacelamiento. Esta adherencia íntima de cepas EPEC produce cambios en el citoesqueleto de la célula del hospedero, con proliferación de filamentos de actina por debajo del sitio de pegamiento de las bacterias.
Estas cepas tienen genes cromosomales que codifican para una proteína que recibió el nombre de tir, la cual se transfiere a la membrana de la célula hospedera y le sirve como receptor que es reconocido por EPEC.
Manifestaciones clínicas.
EPEC se caracteriza por la lesión histopatológica de la superficie apical de los enterocitos, conocida como «Adherencia y y Esfascelamiento» (A/E). Afecta la mucosa intestinal al conducir a la disolución del borde en cepillo por vesiculación de las microvellosidades,con pérdida de disacaridasas, lo que a su vez altera la absorción y conduce a la producción de una diarrea secretora, que puede estar asociada a fiebre.
Una vez que se inician los trastornos intestinales, las manifestaciones de la enfermedad incluyen diarrea, anorexia y desgaste rápido, que puede causar la muerte en el transcurso de días si no se maneja adecuadamente. Aunque la diarrea EPEC se autolimita, esto depende de la respuesta inmune del hospedero, y puede dar lugar a diarrea secretora persistente, deshidratación y muerte.
Epidemiología.
Uno de los aspectos más importantes de la epidemiología de la diarrea producida por EPEC es la población afectada. Esta se presenta principalmente como una enfermedad de niños menores de 2 años de edad. En la actualidad los casos de diarrea por cepas EPEC en países industrializados son poco frecuentes. Sin embargo, en los últimos años se han reportado varios brotes en diferentes países, principalmente en guarderías y otros centros de atención a niños. En los países en desarrollo, la incidencia de diarrea producida por EPEC sigue siendo alta. Diferentes estudios realizados en México, Brasil, y África del Sur refieren que entre 30 y 40% de los casos de diarrea puede ser atribuido a cepas EPEC.
— E. coli enteroinvasiva (EIEC).
Factores de virulencia.
Las cepas EIEC se internalizan y reproducen dentro del citoplasma de las células epiteliales, a las que destruyen. También penetran a los macrófagos. Estas cepas pertenecen a un grupo reducido de serotipos que se parecen bioquímica y antigénicamente al género Shigella. Diversos estudios han concluido que además de genes cromosómicos involucrados en la virulencia, EIEC porta un plásmido de 140 megadaltones (mDa) indispensable para conferir el fenotipo invasivo a estos microorganismos.
Manifestaciones clínicas.
Las cepas EIEC afectan la mucosa del colon y producen un cuadro disentérico similar, aunque menos severo, al que produce Shigella dysenteriae tipo 1. Las manifestaciones clínicas asociadas con ésta infección son evacuaciones de escasas acompañadas de moco y sangre, dolor abdominal tipo cólico y fiebre.
Epidemiología.
EIEC presenta una distribución mundial y se ha reportado como causa frecuente de diarrea en Brasil, Estados Unidos y Europa. Estudios epidemiológicos realizados en México, muestran que las cepas EIEC son poco frecuentes como agentes causales de diarrea, identificándose preferentemente después del sexto mes de vida.
— E. coli enterohemorrágica (EHEC).
El grupo EHEC incluye cepas de diferentes serotipos que presentan las mismas características clínicas, epidemiológicas y patogénicas del serotipo O157:H7, considerado como prototipo del grupo.
EHEC se relaciona con brotes causados por alimentos en países desarrollados. Puede causar diarrea con sangre, colitis hemorrágica y el síndrome urémico hemolítico y púrpura trombocitopénica.
Factores de virulencia.
Las cepas causantes de estos cuadros tienen la capacidad de elaborar una o más citotoxinas. Las citotoxinas que elabora el grupo EHEC originalmente se nombraron verotoxinas (VT), por el efecto citotóxico que causaban sobre cultivos de células Vero (línea celular de riñón de mono). Posteriormente y dado que anticuerpos obtenidos contra la toxina de Shigella (shiga toxin) neutralizaban su actividad, se les denominó toxinas semejantes a Shiga (SLT). Dado que cada grupo de investigación le asignaba el termino con el que mejor se identificaban (VT o SLT), surgió la necesidad de homogeneizar criterios por lo que se llegó al acuerdo de designarlas como Stx, nomenclatura que se utiliza actualmente.
Otra propiedad de virulencia observada en este grupo de microorganismos es la lesión celular «Adherencia y Esfacelamiento» (A/E). En este evento participan tanto genes cromosomales como plasmídicos que inducen y/o regulan la expresión de factores de virulencia de la bacteria. Los genes responsables del daño celular A/E están insertados en una isla de patogenicidad de 35 kilobases llamada locus de esfacelamiento del enterocito (LEE), la cual incluye los dominios de la intimina, el sistema de secreción tipo III y las proteínas Esp de secreción.
Manifestaciones clínicas.
La colitis hemorrágica es un padecimiento autolimitado, caracterizado por diarrea de inicio brusco con dolor abdominal. Las evacuaciones líquidas se acompañan de una descarga hemorrágica. El síndrome urémico hemolítico es una de las principales causas de daño renal en niños, se define por la presencia de anemia hemolítica microangiopática, insuficiencia renal aguda y trombocitopenia.
Epidemiología.
Diferentes serotipos EHEC se han relacionado con la etiología de la diarrea esporádica en adultos, en brotes asociados a la ingesta de alimentos contaminados, colitis hemorrágica, síndrome urémico hemolítico y púrpura trombocitopénica. Estos padecimientos se han observado con mayor frecuencia en países con climas templados como los Estados Unidos, Canadá, Inglaterra, Argentina, Alemania y Japón. Los serogrupos involucrados más comunes son: O26, O111, O121, O145 y particularmente O157. Hasta el momento no existen reportes de cuadros de colitis hemorrágica o síndrome urémico hemolítico en nuestro país relacionados con el aislamiento de E. coli O157:H7 o algún otro serotipo EHEC. Interesantemente, el principal brote de síndrome urémico hemolítico presentado en el año 2011 fue causado por una cepa de E. coli de serotipo no reconocido como enterohemorrágico (O104:H4) o serogrupos enterohemorrágicos (O26, O111, O121, O145) o el clásico serotipo enterohemorrágico O157:H7. El brote se inició en Europa central, principalmente en Alemania y ocasionó más de 900 casos de HUS y 54 personas muertas.
— E. coli enteroagregativa (EAEC).
Esta categoría (EAEC) es heterogénea, se asocia con casos de diarrea aguda o persistente en niños y adultos a nivel mundial. En los últimos diez años ha recibido mayor atención como causante de diarrea acuosa, la cual se presenta como patología persistente e inflamatoria (>14 días) en infantes y niños de países en desarrollo. También se han identificado algunos brotes, de los cuales dos se reportaron en la Ciudad de México (Eslava et al., 1993). Se ha observado, de manera reciente, un aumento de la incidencia de aislados EAEC resistentes a antibióticos. (Arenas-hernández et al., 2012).
Las cepas EAEC derivan su nombre por la forma de adherencia que presentan en células HEp-2 en cultivo. Esta adherencia se caracteriza por la formación de agregados bacterianos, con apariencia de ladrillos apilados («stacked brick»), observados tanto sobre las células como en la superficie del vidrio de la preparación en biocapa. (Fig. 2). Esto no distingue entre cepas patógenas y no patógenas.
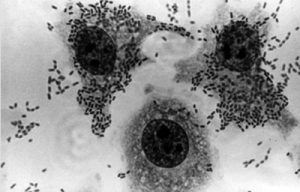
Figura 2. Adherencia agregativa a 3 h. de incubación en células HEp-2 de una cepa de E. coli enteroagregativa. Se observa los agregados bacterianos. Imagen: José Molina, Facultad de Medicina, UNAM.
Factores de virulencia.
Las diferencias esenciales entre las cepas patogénicas y no patogénicas se desconocen, en gran medida, pero los estudios realizados sugieren tres etapas en la infección: 1) Adherencia a la mucosa intestinales mediante fimbrias de adherencia agregativa u otros factores; 2); La estimulación de la producción de moco, con la formación de una biocapa en la superficie de la mucosa; y 3) Toxicidad hacia la mucosa, que se manifiesta por la liberación de citocinas, exfoliación celular, secreción intestinal e inducción de la inflamación de la mucosa. (Boisen et al., 2013).
La adherencia de tipo agregativo ha sido asociada con un plásmido de 65 mDa, que codifica para las fimbrias (AAF/I y AAF/II) de 2 a 3 nm de diámetro. AAF/I media la adherencia a células HEp-2 y hemaglutinación de eritrocitos humanos en la cepa EAEC 17-2.
Savarino reportó en una cepa EAEC una toxina de 110 kDa, la cual se denominó enterotoxina termoestable 1 de EAEC (EAST1). El gen que codifica para esta proteína (astA) está localizado en el plásmido mencionado. EAST1 incrementa los niveles de GMPc y en el modelo in vitro (en cámaras de Ussing) produce un incremento en la corriente de corto circuito (debido a la secreción de líquidos), sugiriendo un efecto enterotóxico semejante al producido por la enterotoxina termoestable de ETEC (STa), sin embargo, no existe reactividad cruzada al utilizar anticuerpos producidos contra STa.
Eslava encontró que cepas EAEC aisladas de niños que fallecieron como consecuencia de diarrea persistente a causa de estas bacterias, elaboraban proteínas de alto peso molecular. En el modelo de asa ligada de intestino de rata, estas proteínas producían acortamiento de las vellosidades intestinales, hemorragia, necrosis y ulceración del epitelio superior.
El gene que codifica para una de las proteínas (108 kDa), está localizado en el mismo plásmido de virulencia de 65-MDa de EACC, el gen ha sido clonado y la proteína nombrada Pet (de las siglas «Plasmid-encoded toxin»). El gen que codifica para la proteína de 116 kDa está localizado en el cromosoma de la bacteria y el producto se llamó Pic («Protein involved in Intestinal Colonization»). La actividad biológica de Pet y Pic ha sido medida en el modelo in vitro. Pet presenta un efecto de enterotoxina. El análisis histopatológico de las muestras de intestino mostró un incremento de la liberación de moco, exfoliación de células, desarrollo de abscesos de las criptas. Pic no mostró efecto sobre las preparaciones de intestino en el mismo modelo, aunque se ha demostrado que posee actividad de mucinasa, resistencia al suero y hemaglutinina.
Manifestaciones clínicas.
Las características clínicas de la infección intestinal por EAEC es una diarrea secretora acuosa con moco y sangre, y febrícula. Un gran porcentaje de pacientes presentan lactoferrina fecal detectable (un indicador sensitivo de leucocitos fecales) y niveles elevados de IL-8 en las heces. Datos de un estudio realizado por Eslava muestran que Pet tiene efecto estimulante sobre macrófagos e induce en estos, la expresión de interleucinas proinflamatorias. Esto sugiere que la infección por EAEC puede estar acompañada de una forma sutil de inflamación de la mucosa.
Epidemiología.
Este grupo de E. coli se ha implicado como agente responsable de brotes de diarrea en diferentes partes del mundo, como causante de diarrea acuosa en turistas que viajan a países en desarrollo y de niños y adultos infectados con HIV. EAEC se describe como un patógeno entérico emergente responsable de cuadros de diarrea aguda y persistente. (Boisen et al., 2013).
Cravioto reportó una estrecha asociación entre el aislamiento de cepas EAEC y la presencia de diarrea persistente en niños de 2 años o menores. Existe una gran cantidad de estudios epidemiológicos que demuestran la asociación de EAEC y diarrea, principalmente en países en desarrollo tales como Bangladesh, India, Brasil, Irán y Venezuela. Caba mencionar un extenso brote en Europa en el año 2011, y otros reportes sobre la alta incidencia de EAEC en Israel, Mongolia, India, Congo, Reino Unido y EEUU. (Boisen et al., 2013; Karch et al., 2012).
— E. coli enterotoxigénica (ETEC)
ETEC se caracteriza por incluir cepas que elaboran enterotoxinas ya sea termoestable (ST) y/o termolábil (LT). Se encontró que el sobrenadante del cultivo de cepas de E. coli aisladas de individuos con diarrea ocasionaban la distensión de asas ligadas de intestino de conejo. El efecto observado era similar al inducido por cultivos de Vibrio cholerae O1, lo que condujo a plantear que las cepas de E. coli también elaboraban enterotoxinas.
Factores de virulencia.
Las cepas ETEC elaboran ya sea una o las dos enterotoxinas (LT y/o ST) por su sensibilidad y tolerancia al calor respectivamente. LT es semejante en estructura y función a la toxina causante del cólera (CT) producida por V. cholerae O1. Tiene el mismo receptor celular (GM1) y actividad biológica similar. La toxina LT es un dímero con peso molecular de 86-kDa, compuesta por una subunidad A de 28-kDa y 5 subunidades B iguales de 11.5-kDa cada una. Las subunidades B están arregladas en forma circular y es el componente de la toxina que se une al receptor GM1 y/u otras glucoproteínas intestinales. La subunidad A constituida por las fracciones A1 y A2 unidas entre sí por un enlace disulfuro, es la porción de la toxina que tiene la actividad enzimática. Los genes que codifican para la expresión de LT se localizan en plásmidos que también pueden tener los genes que codifican ST y/o los antígenos del factor de colonización (CFAs).
El blanco celular de LT es la adenilato ciclasa, la fracción A1 posee actividad de ADP-ribosiltransferasa por lo que transfiere una molécula de ADP-ribosa del NAD a la subunidad alfa de la proteína GS (proteína que acopla GTP) lo que estimula la actividad de la adenilato ciclasa. Esta ADP-ribosilación ocasiona que la adenilato ciclasa se mantenga permanentemente activada conduciendo a un incremento de los niveles intracelulares del AMP cíclico (AMPc). El resultado de dicho proceso es la estimulación de la secreción de Cl- por las células de las criptas y la inhibición de la absorción de NaCl por las células de las vellosidades. El efecto es una diarrea osmótica.
ST tiene variedades que son de bajo peso molecular. Los enlaces disulfuro de éstas son los que contribuyen a la estabilidad térmica que presentan estas enterotoxinas. Son dos clases STs difieren tanto en su estructura como en su mecanismo de acción. Los genes que codifican para la expresión de ambas se encuentran en plásmidos. La enterotoxina Sta descrita también como ST-I es producida tanto por cepas ETEC como por otras bacterias gramnegativas. Sin embargo STb, la otra variedad de estas enterotoxinas, solo es elaborada por cepas ETEC.
El blanco celular de STa es la enzima guanilato ciclasa C (GC-C) que se localiza en la membrana apical de las células del epitelio intestinal; la actividad de GC da lugar a un incremento en los niveles intracelulares de GMPc. Esta activación estimula la secreción de cloro y/o la inhibición de la absorción de cloruro de sodio cuyo resultado es la secreción de líquido intestinal.
Con respecto a la enterotoxina STb, se le ha relacionado principalmente con cepas ETEC aisladas de cerdos, aunque se ha identificado también en cepas de origen humano.
Manifestaciones clínicas.
El cuadro clínico que inducen estas bacterias es similar al que se observa en el caso del cólera, presentándose de ocho a 12 evacuaciones al día por un periodo de cuatro a cinco días. Las cepas ETEC son una causa importante de diarrea en niños menores de cinco años de edad y una de las causas más frecuentes de diarrea del viajero.
Epidemiología.
Las cepas ETEC son una causa frecuente de diarrea en lactantes de países en desarrollo, así como la causa más común de diarrea en individuos de países industrializados que viajan a zonas menos desarrolladas del mundo. Cravioto encontró que en México, las cepas ETEC eran el grupo de bacterias de origen intestinal que se aislaban con mayor frecuencia durante los primeros años de vida. El análisis de los serogrupos ETEC en diferentes estudios señalan a O8, O25, O20 y O6, como los más comunes en nuestro país.
Otra alternativa para identificar cualquier grupo de E. coli, se basa en técnicas de recombinación genética que permiten el desarrollo de sondas moleculares para la identificación de secuencias genes relacionados con la producción de factores de patogenicidad de enterobacterias. Estas sondas están elaboradas con secuencias específicas de DNA marcado con fósforo radiactivo o con enzimas, que en un proceso de hibridación, reconocen secuencias de ADN complementario en las cepas problema.
E. coli se aisla de heces en medios como Mac Conkey o eosina azul de metileno (EMB), estos permiten la diferenciación de las bacterias intestinales por sus características morfológicas y de afinidad a la lactosa. Para la identificación de la bacteria a nivel de especie, se utilizan métodos automatizados (Vitek). Para la tipificación serológica de E. coli se identifican los antígenos: somático, flagelar y capsular.
Una técnica de biología molecular muy utilizada actualmente es la amplificación de secuencias específicas para un factor de virulencia (enterotoxinas, citotoxinas, adherencia, invasividad) de una cepa en particular (EPEC, ETEC, EHEC, EIEC, EAEC) por medio de la técnica de reacción en cadena de la polimerasa (PCR).
Tratamiento.
Desde el punto de vista terapéutico los cuadros producidos por cepas EPEC y ETEC deben manejarse con rehidratación, de preferencia por vía oral, hasta que el proceso infeccioso se autolimite. En el caso de los cuadros asociados con EHEC y en particular EIEC está justificado el empleo de antimicrobianos por el ataque al estado general y el riesgo de transmisión intrafamiliar.
Prevención y control.
El control general de infecciones por cualquier cepa de E. coli exige mejores condiciones sanitarias, ambientales, en la preparación adecuada de alimentos en la mejoría de la higiene personal. Las medidas son análogas cuando se trata del control de brotes intrahospitalarios. Adicionalmente se están desarrollando trabajos en ese sentido para disponer de productos inmunizantes a base de enterotoxinas y de factores adhesivos que poseen cepas de los diferentes grupos de E. coli asociadas con procesos diarreicos, los cuales podrán contribuir a disminuir la morbilidad causada por estas bacterias, en particular en la población infantil y en los individuos que viajan de una zona de bajo riesgo de diarrea a una de alta prevalencia.
Vínculos.
– Bryan A, Youngster I, McAdam AJ. Shiga Toxin Producing Escherichia coli. Clin Lab Med. 2015 Jun;35(2):247-72. doi: 10.1016/j.cll.2015.02.004.
– Acosta-Pérez G, Ibáñez-Cervantes G, Bello-López JM, Hernández JM, Hernández-Montañez Z, Giono-Cerezo S, León-García G, León-Avila G. Structural Diversity of Class 1 Integrons in Multiresistant Strains of Escherichia coli Isolated from Patients in a Hospital in Mexico City. Curr Microbiol. 2015 Jul 23.
– Patzi-Vargas S, Zaidi MB, Perez-Martinez I, León-Cen M, Michel-Ayala A, Chaussabel D, Estrada-Garcia T. Diarrheagenic Escherichia coli carrying supplementary virulence genes are an important cause of moderate to severe diarrhoeal disease in Mexico. PLoS Negl Trop Dis. 2015 Mar 4;9(3):e0003510. doi: 10.1371/journal.pntd.0003510. eCollection 2015 Mar.
– Sanchez-Villamil J, Navarro-Garcia F. Role of virulence factors on host inflammatory response induced by diarrheagenic Escherichia coli pathotypes. Future Microbiol. 2015 Jun;10:1009-33. doi: 10.2217/fmb.15.17.
– Ares MA, Alcántar-Curiel MD, Jiménez-Galicia C, Rios-Sarabia N, Pacheco S, De la Cruz MA. Antibiotic Resistance of Gram-Negative Bacilli Isolated from Pediatric Patients with Nosocomial Bloodstream Infections in a Mexican Tertiary Care Hospital.Chemotherapy. 2014 May 10;59(5):361-368.
– Gómez-Aldapa CA, Rangel-Vargas E, Bautista-De León H, Castro-Rosas J. Presence of non-O157 Shiga toxin-producing Escherichia coli, enterotoxigenic E. coli, enteropathogenic E. coli and Salmonella in fresh beetroot (Beta vulgaris L.) juice from public markets in Mexico. J Sci Food Agric. 2014 Feb 14. doi: 10.1002/jsfa.6614.
– Dinesen L, Harbord M. Acute diarrhoea. Medicine, February 2013; 41(2):104-107. Artículo de integración. Patógenos causantes de diarrea aguda.
– Matthew A. Croxen et al. Recent Advances in Understanding Enteric Pathogenic Escherichia coli. Clin. Microbiol. Rev. October 2013 26(4): 822-880
– Nadia Boisen, Karen A. Krogfelt, James P. Nataro. Chapter 8 – Enteroaggregative Escherichia coli. In: Escherichia Coli (Second Edition), 2013, Academic Press. Pages 247-273.
– Keefe Davis TK, McKee R, Schnadower D, Tarr PI. Treatment of Shiga Toxin–Producing Escherichia coli Infections. Review. Infectious Disease Clinics of North America, September 2013;27(3):577-597.
– Cerna-Cortes JF, Gómez-Aldapa CA, Rangel-Vargas E, Ramírez-Cruz E, Castro-Rosas J. Presence of indicator bacteria, Salmonella and diarrheagenic Escherichia coli pathotypes on mung bean sprouts from public markets in Pachuca, Mexico.
Food Control, June 2013; 31( 2):280-283.
– Bleibtreu A, Gros PA, Laouénan C, Clermont O, Le Nagard H, Picard B, Tenaillon O, Denamur E. Fitness, stress resistance, and extraintestinal virulence in Escherichia coli. Infect Immun. 2013 Aug;81(8):2733-42. doi: 10.1128/IAI.01329-12.
– Arenas-Hernández MM, Martínez-Laguna Y, Torres AG. Clinical implications of enteroadherent Escherichia coli. Curr Gastroenterol Rep. 2012 Oct;14(5):386-94. doi: 10.1007/s11894-012-0277-1.
– Jafari A, Aslani MM, Bouzari S. Escherichia coli: a brief review of diarrheagenic pathotypes and their role in diarrheal diseases in Iran. Iran J Microbiol. 2012 Sep; 4(3):102-17.
– Karch H, Denamur E, Dobrindt U, Finlay BB, Hengge R, Johannes L, Ron EZ, Tønjum T, Sansonetti PJ, Vicente M. The enemy within us: lessons from the 2011 European Escherichia coli O104:H4 outbreak. EMBO Mol Med. 2012 Sep;4(9):841-8. doi: 10.1002/emmm.201201662.
– Hernández Cortez C, Aguilera Arreola MG, Castro Escarpulli G. Situación de las enfermedades gastrointestinales en México. Enf Inf Micobriol. 2011; 31(4):137-151. Para revisar los diferentes tipos de diarrea y los principales agentes etiológicos.
– Janda JM, Abbott SL. Revisiting Bacterial Gastroenteritis, Part I: Issues, Possible Approaches, and an Ever-Expanding List of Etiologic Agents. Clinical Microbiology Newsletter, 15 May 2011;33(10):71-76.
– Michael Janda, and Sharon L. Abbott. Revisiting Bacterial Gastroenteritis, Part II: Issues, Possible Approaches, and an Ever-Expanding List of Etiologic Agents. Clinical Microbiology Newsletter 1 June 2011;33(11):79-86. Para integrar adecuadamente, este segundo artículo incluye los patógenos poco frecuentes, causantes de gastroenteritis.
– Hodges K, Gill R. Infectious diarrhea: Cellular and molecular mechanisms. Gut Microbes 2010;1(1): 4-21. DOI: 10.4161/gmic.1.1.11036 Integración. Mecanismos celulares o moleculares asociados al síndrome diarreico. Se contemplan patógenos virales y parasitarios.
– Viswanathan VK, Hodges K & Hecht G. Review: Enteric infection meets intestinal function: how bacterial pathogens cause diarrhoea. Nat Rev Microbiol, Feb 2009;7:110-119. doi:10.1038/nrmicro2053 De gran utilidad para iniciar con el estudio de las enfermedades bacterianas causantes de diarrea. Tipos de diarrea.
– Croxen MA, Brett Finlay B. Molecular mechanisms of Escherichia coli pathogenicity. Nat Rev Microbiol Jan 2010;8:26-38| doi:10.1038/nrmicro2265
– Viswanathan VK, Hodges K & Hecht G. Review: Enteric infection meets intestinal function: how bacterial pathogens cause diarrhoea. Nat Rev Microbiol, Feb 2009;7:110-119 doi:10.1038/nrmicro2053 Muy bueno para iniciar con el estudio de las enfermedades bacterianas causantes de diarrea. Tipos de diarrea.
– Johnson TJ, Nolan LK. Pathogenomics of the virulence plasmids of Escherichia coli. Microbiol Mol Biol Rev 2009;73(4):750-774. doi:10.1128/MMBR.00015-09
– Iguchi A, Thomson NR, Ogura Y, Saunders D, Ooka T, Henderson IR, Harris D, et al. Complete genome sequence and comparative genome analysis of enteropathogenic Escherichia coli O127:H6 strain E2348/69. J Bacteriol. Jan 2009;191(1):347-54. doi:10.1128/JB.01238-08
– Estrada-Garcia T, Lopez-Saucedo C, Thompson-Bonilla R, Abonce M, Lopez-Hernandez D, et al. Association of Diarrheagenic Escherichia coli Pathotypes with Infection and Diarrhea among Mexican Children and Association of Atypical Enteropathogenic E. coli with Acute Diarrhea. J Clin Microbiol 2009;47: 93-98. doi:10.1128/JCM.01166-08
– Dean P, Kenny B. The effector repertoire of enteropathogenic E. coli: ganging up on the host cell. Curr Opin Microbiol, 2009;12 (1):101-109. doi:10.1016/j.mib.2008.11.006
– Tsolis RM, Young GM, Solnick JV & Bäumler AJ. Review: From bench to bedside: stealth of enteroinvasive pathogens. Nat Rev Microbiol Dec 2008;6: 883-892 | doi:10.1038/nrmicro2012 Otro artículo que ofrece información general sobre bacterias causantes de diarrea.
– Flores J, DuPont HL, Lee SA, Belkind-Gerson J, Paredes M, Mohamed JA, Armitige LY, Guo DC, Okhuysen PC. Influence of host interleukin-10 polymorphisms on development of traveler’s diarrhea due to heat-labile enterotoxin-producing Escherichia coli in travelers from the United States who are visiting Mexico. Clin Vaccine Immunol. 2008 Aug;15(8):1194-8.
– Rasko DA, Rosovitz MJ, Myers GS, Mongodin EF, Fricke WF, Gajer P,(…), Ravel J. The pangenome structure of Escherichia coli: Comparative genomic analysis of E. coli commensal and pathogenic isolates. J Bacteriol, 2008;190 (20):6881-6893. doi:10.1128/JB.00619-08
– John N. Sofos. Challenges to meat safety in the 21st century. Meat Science, Jan-Feb 2008;78(1-2):3-13. Sobre la importancia de la contaminación de carnes con patógenos (E. coli, Salmonella, Campylobacter, virus, protozoos, medidas de control, entre otros).
– Vidal J, Canizález-Román A, et al. Articulo de Revision. Patogénesis molecular, epidemiología y diagnóstico de Escherichia coli enteropatógena. Salud Pública Méx 2007;49(5):376-385.
– Eguiarte Qadri F, Svennerholm AM, Faruque AS, Sack RB. Enterotoxigenic Escherichia coli in developing countries: epidemiology, microbiology, clinical features, treatment, and prevention. Clin Microbiol Rev. Jul 2005;18(3):465-83.
– David B. Huang, Herbert L. DuPont. Enteroaggregative Escherichia coli: An emerging pathogen in children. Seminars in Pediatric Infectious Diseases, October 2004; 15(4):266-271.

