Introducción.
Strongyloides stercoralis es un geohelminto que se localiza en el intestino delgado en el humano, el huésped principal. Existen alrededor de 50 especies de Strongyloides, las cuales infectan un amplio rango de huéspedes. Además, perros, gatos y otros mamíferos pueden actuar como reservorios de S. stercoralis.
La infección puede cursar asintomática, pero existe una gran morbi-mortalidad en personas inmunocomprometidas, en sujetos desnutridos y pacientes con otras enfermedades que pueden desarrollar hiperinfecciones; el parásito tiene el potencial de producir autoinfección interna, externa y multiplicarse en los seres humanos. (Pichard et al., 2014; Kim et al., 2016).
La strongyloidosis es una parasitosis subdiagnosticada, incluida en la lista de enfermedades tropicales menospreciadas (neglected tropical diseases o NTDs); se estima que existen 30 – 100 de millones de personas infectadas a nivel global y un número no determinado en riesgo de infección, aunque estas cifras se manejan desde hace más de una década. En algunas publicaciones recientes se menciona que la cifra podría alcanzar 100 millones de afectados o más. (Hays et al., 2015).
Este nematodo es endémico en regiones geográficas tropicales, subtropicales y hasta templadas donde se dan las condiciones adecuadas para su desarrollo (temperatura, humedad, materia orgánica y condiciones sanitarias deficientes), y se carece de información sobre su prevalencia. Debe contemplarse el impacto zoonótico de especies de Strongyloides de animales domésticos, ganado y otros. (Bethony et al., 2006; Olsen et al., 2009; Utzinger et al., 2012, WHO; Thamsborg et al., 2016).
MORFOLOGÍA
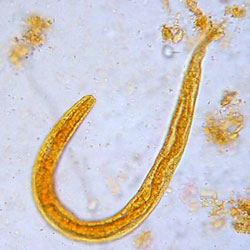
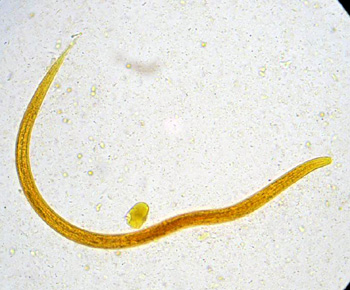
Este parásito facultativo tiene cuerpo filiforme, esófago recto y extremo posterior aguzado. La hembra parásita mide 2 mm de longitud. Las larvas filariformes, formas infectivas, miden alrededor de 600 µm de longitud, tienen esófago recto y extremo posterior ligeramente bifurcado, en tanto que las larvas rabditoides, formas diagnósticas, tienen menor tamaño y bulbo esofágico prominente.
Los huevos inmersos en la submucosa del intestino delgado son ovalados y miden alrededor de 50 µm de longitud.
Las hembras y machos de vida libre presentan bulbo esofágico evidente; la primera mide 1 mm de longitud.
Strongyloides stercoralis. Larva filariforme, la forma infectiva. M. en C. Rosa María Sánchez M, Depto. de Parasitología, ENCB-IPN.
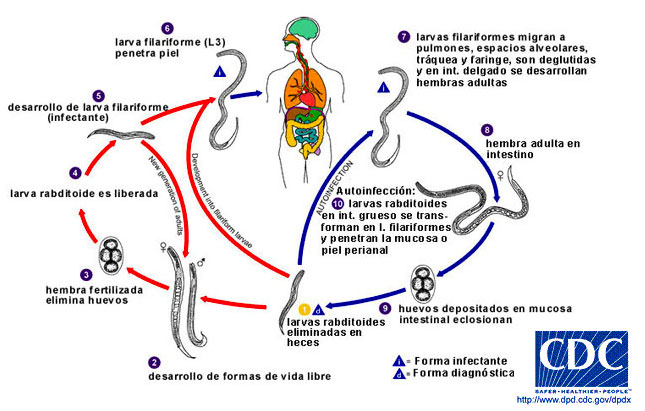
CICLO BIOLÓGICO:
Las larvas rabditoides (eliminadas en heces) sufren 2 mudas y se transforman en larvas filariformes (L3), infectivas (ciclo directo), que penetran la piel intacta o mucosas, dando lugar, en la mayoría de los casos, después de migración por tejidos y su instalación en duodeno y yeyuno proximal, a una enfermedad benigna, crónica. Las hembras se introducen en la submucosa y producen cantidades irregulares y escasas de huevos (por partenogénesis mitótica), los cuales eclosionan rápidamente y liberan larvas rabditoides que son eliminadas con las heces fecales; si estas larvas caen en suelos húmedos y sombreados (fecalismo al ras del suelo) maduran como formas adultas dimórficas (hembras y machos) de vida libre, con potencial de desarrollo en larvas filariformes infectantes (ciclo indirecto).
Algunas larvas rabditoides se transforman en la forma invasiva (larva filariforme) en intestino grueso, penetran por la mucosa – autoinfección interna – y repiten el ciclo en el mismo hospedero. En ocasiones se presenta autoinfección externa, asociada a la penetración de larvas filariformes a través de la región perianal, con migración subcutánea de estas formas – larva currens – y posterior migración pulmonar, que finaliza con el ingreso de las formas juveniles a tracto digestivo.
La autoinfección es una característica de S. stercoralis, la cual permite que la enfermedad persista durante años, con niveles bajos de larvas, en sujetos que viven en zonas endémicas.
Patogenia:
La respuesta inmunológica ante varias parasitosis por helmintos es principalmente del tipo TH2, con una compleja interacción entre anticuerpos, tales como IgE, IgG4, citocinas (sobre todo IL-4 e IL-5) y eosinófilos circulantes y tisulares.
En los pacientes bajo tratamiento con corticoesteroides se aprecia la supresión aguda de eosinófilos y de la activación de células T, en tanto que la infección por HTLV-1 incrementa la producción de IFN-gamma y reduce los niveles de IgE.
Histopatología.
Los hallazgos inmunohistopatológicos corresponden a diversos grados de atrofia de las microvellosidades intestinales e hiperplasia de las criptas, con infiltración de células plasmáticas y eosinófilos. Las formas severas llegan a expresarse en la forma de úlceras de hasta 0.5 cm con infiltración larvaria en paredes intestinales y hasta en la luz de capilares y linfáticos, que constituyen otra vía de diseminación a otros tejidos. También existe un aumento en la expresión del componente secretor (SC) y la expresión disminuída de HLA-DR en células epiteliales. Estos cambios están correlacionados con el grado de severidad del cuadro clínico.
Factores de riesgo. Hiperinfección.
La autoinfección permite cuadros clínicos de diversa severidad; la infección por Strongyloides stercoralis puede persistir durante años. Varias patologías asociadas a inmunocompromiso, en particular, las que impactan la inmunidad celular, se han relacionado con hiperinfección y diseminación de los parásitos a diversos tejidos, como la infección por el virus linfotrópico HTLV-1, el empleo de corticoesteroides, fármacos inmunosupresores, diabetes, trasplantes (Kim et al., 2016), HIV+, enfermedad pulmonar crónica, procesos malignos, lupus eritematoso sistémico, nefropatías, desnutrición, tuberculosis, alcoholismo. ( (Henriquez-Camacho et al., 2016).
La carga parasitaria y la transformación de larvas rabditoides en formas filariformes aumentan y las manifestaciones clínicas dependen de la ubicación de los parásitos. (Fardet et al., 2007; Roxby et al., 2009; Siegel et al., 2012; Toledo et al., 2015).
Espectro clínico.
Los cuadros clínicos debidos a S. stercoralis oscilan desde infecciones asintomáticas y enfermedad leve hasta parasitosis crónicas: la multiplicación no controlada del parásito (hiperinfección) y la diseminación a diferentes órganos internos en pacientes inmunocomprometidos, da lugar a tasas de mortalidad hasta del 85%. (Mejia & Nutman. 2012; Prichard et al., 2014).
– Penetración de larvas filariformes, formas infecciosas – Las lesiones dermatológicas ocasionadas por la penetración consisten en una reacción inflamatoria caracterizada por pápulas, eritema y edema. El prurito puede ser importante. Se han reportado pacientes con urticaria generalizada de corta duración y cuadros ocasionales de autoinfección externa, larva currens, con formación de trayectos indurados, eritematosos y pruriginosos en tórax, abdomen, ingles y glúteos, miembros inferiores, de desaparición rápida (horas – días). El número y la intensidad pueden variar en personas inmunocomprometidas. (Pichard et al., 2014).
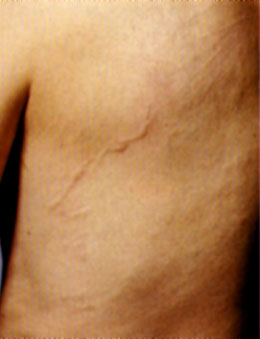
Larva currens. CDC
– La migración larvaria por el sistema respiratorio – con ruptura de capilares y microhemorragias intraalveolares y la reacción de hipersensibilidad ante las larvas, puede dar lugar a un cuadro pulmonar (síndrome de Loeffler o eosinofilia pulmonar simple o neumonitis eosinofílica: sibilancias, tos, disnea, dolor torácico, taquipnea, eosinofilia pulmonar), hemoptisis, fibrilación atrial, alcalosis respiratoria. La hemorragia alveolar es una manifestación frecuente del síndrome de hiperinfección, con o sin hemorragias petequiales o hiperemia en tráquea y laringe; también existen reportes de neumotórax, asma bronquial, bronconeumonía, abscesos, y patología obstructiva asociada a strongyloidiasis pulmonar en individuos con alto riesgo.
– Los parásitos adultos hembras, huevos y larvas en intestino delgado (duodeno y yeyuno) – se encuentran en submucosa superficial y criptas; estas formas son causa de trauma, descarga mucosa y ulceraciones.
Los trastornos fisiológicos incluyen esteatorrea, síndrome de malabsorción, enteropatía con pérdida proteica, de lípidos y vitaminas liposolubles, desequilibrio hidroelectrolítico e íleo paralítico. La eosinofilia es un hallazgo frecuente en sujetos inmunocompetentes, así como elevaciones de IgE específica y no específica.
La severidad de la infección intestinal en sujetos inmunocompetentes, aguda o crónica, depende de la carga parasitaria y la respuesta celular. Debe tenerse en cuenta la posibilidad de coinfección (geohelmintos, protozoos, otros).
Las manifestaciones clínicas pueden ser las de una úlcera péptica. Otros signos y síntomas prevalentes son: náusea y vómito, malestar abdominal, pérdida de peso, episodios de diarrea y constipación. También puede presentarse sangrado intestinal.
Es importante considerar la carga parasitaria. En casos severos (asociados con frecuencia a hiperinfección) se presenta aumento de las manifestaciones clínicas pulmonares y digestivas; se han reportado parásitos adultos y sus productos, principalmente en infecciones masivas e inmunosupresión. (Mohamed et al., 2016).
La hiperinfección resulta de una autoinfección acelerada, con extensión a todo el intestino delgado, e incluso colon. Se han reportado con frecuencia diferentes asociaciones de: dolor abdominal, diarrea acuosa, constipación, anorexia, pérdida de peso, náusea, vómito, sangrado gastrointestinal, malabsorción intestinal con evacuaciones esteatorreicas, hiproteinemia con hipoalbuminemia y edema periférico, persitalsis disminuida, íleo, obstrucción intestinal y trastornos electrolíticos. Se han encontrado casos de colitis seudomembranosa, proctitis y apendicitis.
La infección diseminada implica el involucramiento de órganos que no están incluídos en el ciclo biológico del parásito, tales como SNC, tracto urinario, piel, otros.
Es usual la disminución o nula capacidad para montar una respuesta eosinofílica.
Cabe resaltar que las infecciones bacterianas secundarias, debidas al arrastre de bacterias por las larvas, son la causa inmediata de muerte en más del 80% de los pacientes. Los reportes más frecuente corresponden a Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis, Pseudomonas, Enterococcus faecalis, estafilococos coagulasa negativos, Streptococcus bovis y Streptococcus pneumoniae. (Agrawal V, 2009).
Diagnóstico.
El antecedente de estancia o residencia en zonas endémicas y la presencia de eosinofilia periférica (en sujetos inmuno- competentes, no sujetos a corticoterapia) es de utilidad, aunque el amplio espectro clínico y la eliminación irregular de larvas en materia fecal dificultan el diagnóstico. Se considera una parasitosis subdiagnosticada.
Existe una gran variedad de técnicas que son utilizadas en el diagnóstico, parasitoscópicas, serológicas, de cultivo y moleculares, con ventajas y desventajas propias. (Inês Ede J., et al., 2011; Levenhagen & Costa-Cruz. 2014; Khurana & Sethi. 2017).
Los métodos parasitológicos, de baja sensibilidad, debido a la eliminación escasa e irregular de larvas en heces. (Levenhagen & Costa-Cruz. 2014), son:
– Series de exámenes coproparasitoscópicos de concentración, como el método de Ritchie, Kato-Katz. Las larvas rabditoides son eliminadas en materia fecal de manera irregular por lo que estos exámenes tienen baja sensibilidad. En ocasiones es posible encontrar en una misma muestra fecal larvas rabditoides y filariformes (Requena-Méndez et al., 2013; Agrawala, et al. 2009).
Cultivos.
– Cultivo en placa de agar para la búsqueda e identificación de larvas rabditoides.
– Algunos autores sugieren realizar de manera simultánea el método de Baermann (Requena-Méndez et al., 2013); ambas técnicas se emplean también en la identificación de género/especie, ya que las zonas endémicas de strongyloidosis coinciden con frecuencia con las de uncinarias. Las larvas filariformes de Strongyloides stercoralis presentan el extremo posterior bifurcado y esófago de menor longitud que las larvas de las uncinarias. Es importante que los especímenes se manipulen con cuidado. (Inês Ede J., et al., 2011).
– También se emplea, aunque es menos eficiente, el método de Harada-Mori.
Otros.
– Sondeo duodenal, endoscopía gastrointestinal, biopsia, son recursos invasivos, en la mayor parte de los casos no disponibles en las zonas endémicas. Histológicamente pueden identificarse ulceraciones, distorsión de criptas, atrofia de vellosidades, infiltrados inflamatorios, zonas de necrosis y los parásitos.
– En pacientes con hiperinfección es posible el hallazgo de larvas rabditoides y filariformes en los exámenes CPS, en lavado de secreción bronquial y líquido alveolar mediante microscopía de fluorescencia, LCR y biopsia de sistema digestivo. El hallazgo de sangre visible u oculta en heces es frecuente (Levenhagen & Costa-Cruz. 2014).
– BH. Eosinofilia en inmunocompetentes.
Los métodos serológicos y moleculares:
– ELISA, cuya sensibilidad oscila entre 84 – 95%, de especificidad controvertida en zonas endémicas de geohelmintos. Pueden dar lugar a que se sobrestime la prevalencia de la parasitosis debido a la reactividad cruzada con otros nematodos.
La serología se considera una herramienta de utilidad en estudios epidemiológicos y en casos individuales. Para detección de antígenos, anticuerpos y complejos inmunes en muestras séricas o coproantígenos en heces (Requena-Méndez et al., 2013;Levenhagen & Costa-Cruz. 2014).
– IFAT. Inmunofluorescencia directa con anticuerpos monoclonales; es una técnica más compleja en relación a otros métodos serológicos y requiere de personal técnico bien preparado para la preparación del antígeno y la lectura de las preparaciones. evaluation. De mayor sensibilidad y especificidad que ELISA: inmunoblot, precipitación con sistemas de precipitación con luciferasa (LIPS) (Khurana & Sethi. 2017).
– PCR. La optimización y estandarización son muy importantes para incrementar la sensibilidad de los diagnósticos moleculares (Mendes et al., 2017).
– Se requiere mayor estudio de la biología molecular de este parásito: estudios de genómica fundamental, proteómica y metabolómica, que ofrezcan bases aplicadas para la prevención y tratamiento. (Sotillo et al., 2012).
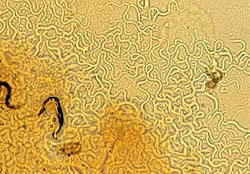
S. stercoralis. Cultivo en placa. Parásitos y sus trayectos. Chiang Mai University, Thailand
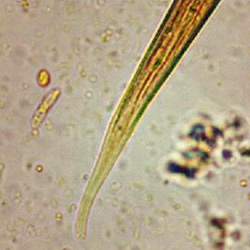
S. stercoralis. Extremo posterior bifurcado de larva filariforme. Imagen cortesía de: M. en C. Rosa María Sánchez M, Depto. de Parasitología, ENCB-IPN.